Forskere markerer logistikk mareritt i møte med kromosom-kontroller
 Evolution news; 5. september 2017
Evolution news; 5. september 2017
Oversatt herfra.
Bilde 1. Salk forskere ser DNA-strukturen i cellen for 1.gang Video.
Intet menneske har noen gang hatt et så stort logistikkproblem. Tenk på at du har nok DNA i kroppen din til å nå Pluto, og alt må være raskt lesbart og tilgjengelig fra et volum som er en tusendel av en millimeter i diameter. Kongressens bibliotek virker spakt i sammenligning. Å, og la oss ikke glemme - alt det DNAet må kopieres, separeres og ompakkes raskt hver gang en celle deler seg. Alt dette må fungere i en organisme som er i stand til å stupe i volter, dypdykke eller fly i en vingedrakt.
En sikker markør for intelligent design er at jo nærmere du ser på et designet objekt, jo mer komplisert blir det. Det er visselig sant for kromosom-pakking. Siden oppdagelsen av DNA har forskere vært i stand til å kikke nærmere og nærmere i løpet av flere tiår. Hver gang de gjør det, finner de mer komplikasjoner i logistikkproblemene som en celle står overfor. Likevel virker DNA-operasjoner bemerkelsesverdig bra. Hvis de ikke gjorde det, ville vi ikke være omkring til å vite noe annet.
 Ikke-forenkling av kromatin
Ikke-forenkling av kromatin
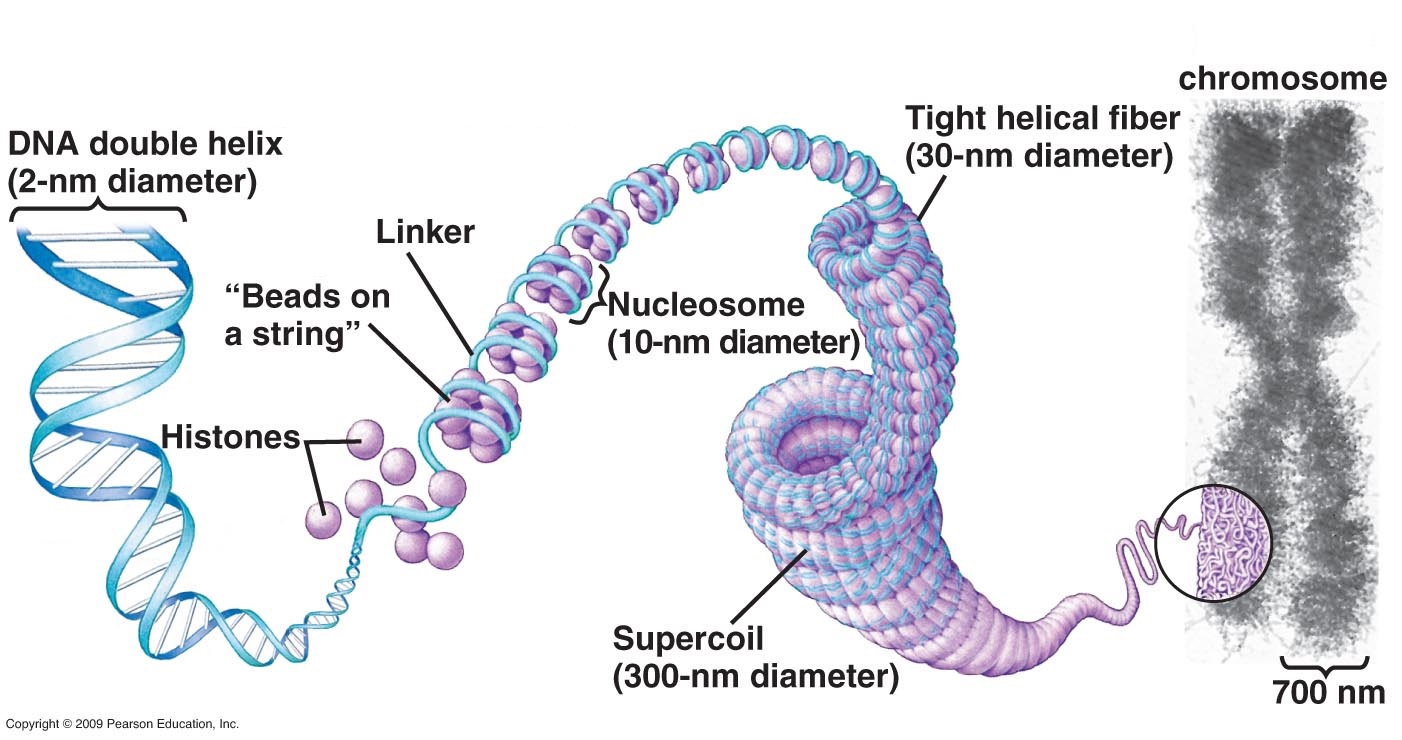
Molekylære biologer fant ut in vitro (utenfor levende celler) at DNA brytes rundt baller av protein kalt kromatin, som danner nukleosomer. De forestilte nukleosomer som spolende og superspolende inn i høyere ordens strukturer med økende diameter, til de kjente kromosomer tok form. Kromatinballene ble antatt å være av samme størrelse (ca. 11 nm). Et nytt funn som ble annonsert av Salk Institutt viser nå at de varierer betydelig i diameter, noe som gir et annet nivå av fleksibilitet for pakking - og dermed en ny hodepine for logistikk.
Ved å løse et "langvarig biologisk mysterium for DNA-organisasjon", belyste forskerne en høyere ordens struktur av DNA i kjernen, med funksjonelle konsekvenser. I et videoklipp (øverst på dette innlegget), forklarer Clodagh O'Shea, tydelig begeistret av funnene at hver celle, mens den har samme kopi av genomet, leser og tolker det for sin rolle i kroppen. Den organiserte informasjonen må arves ved mitose, så vel som sekvensinformasjon.
Horng Ou forklarer så hvordan Salk-teamet kunne avbilde kromatin i naturlig tilstand i intakte celler. "Livet inntreffer i 3D, riktig," fortsetter O'Shea; "Form gir mulighet til funksjon." Med de nye bildeteknikkene kan teamet begynne å se DNA slik enzymer ser det.
Bilde 2. Nukleosomet -standard forklaring
Resultatene deres ble publisert i Science -her:
Det som O'Sheas team så, i både hvilende og delende celler, var kromatin hvis "perler på en streng" ikke formet noen høyere rekkefølge struktur på de teoretiserte 30 eller 120 eller 320 nanometer. I stedet dannet de en semi-fleksibel kjede som de målrettet målte som kontinuerlig varierende langs lengden på mellom bare 5 og 24 nanometer, som bøyde og flekset seg for å oppnå ulike nivåer av komprimering . Dette antyder at det er kromatinets pakningsdensitet, og ikke noen høyere rekkefølge struktur, som bestemmer hvilke områder av genomet som er aktive og som undertrykkes.
Så det er ikke noen "tegneserie -lignende" type av organisasjon, som det har vært lært i lærebøker, men et komplekst tomrom og tettpakkede deler, topper og daler som på den ene side gir en langt mer effektiv pakkingstetthet, med strammere kontroller på tilgang for enzymer og transkripsjonsfaktorer. O'Shea oppsummerer det:
"Vi viser at kromatin ikke trenger å danne diskrete høyere ordningsstrukturer for å passe inn i kjernen," tilføyer O'Shea. "Det er paknings-tettheten som kan forandre og begrense tilgjengeligheten til kromatin, og gir en lokal og global strukturell basis der forskjellige kombinasjoner av DNA-sekvenser, nukleosom-variasjoner og modifikasjoner kan integreres i kjernen for å finjustere funksjonell aktivitet og tilgjengelighet av våre genomer."
 Kontrollerer gentilgang
Kontrollerer gentilgang
Hvordan bestemmer en celle hvilken kombinasjon av gener som er nødvendig for dens funksjon i kroppen? En oppføring i Oxford Science Blog -her spør, "Hvordan vet en celle hvilken kombinasjon av de 20.000 gener den skal aktivere for å produsere sin spesifikke verktøykasse?" Se i det som tidligere ble kalt junk DNA for ledetråder:
Svaret på dette spørsmålet kan finnes i DNA-stykkene som ligger mellom våre proteinproduserende gener. Selv om cellene våre inneholder mye DNA, er bare en liten del av dette faktisk sammensatt av gener. Vi forstår ikke skikkelig funksjonen til det meste av denne andre sekvensen, men vi vet at noe av det har en funksjon i å regulere genenes aktivitet. En viktig klasse av slike regulatoriske DNA-sekvenser er forsterkerne, som fungerer som brytere som kan slå på gener i cellene der de er påkrevd.
Brytere er ikke søppel. For å vise at de har viktige funksjonelle roller, så teamet på en forsterker kalt CTCF.
"Forskere har identifisert viktige proteiner som synes å definere og hjelpe til med å organisere denne domenestrukturen. Et slikt protein kalles CTCF, som binder seg til en bestemt DNA-sekvens som ofte finnes ved grensene til disse domenene. For å utforske funksjonen av disse CTCF-grensene mer detaljert og for å undersøke hvilken rolle de kan spille i forbindelses-forsterkere til de riktige genene, studerte vårt team domenet som inneholder a-globin-genene, som produserer det hemoglobinet som våre røde blodlegemer bruker til å sirkulere oksygen i kroppene våre.
For det første, som forventet fra CTCFs rolle i å definere grenser, viste vi at CTCF-grenser bidrar til å organisere a-globin-gener i en bestemt domenestruktur i røde blodlegemer. Dette gjør at forsterkerne fysisk kan interagere med og slå på a-globin-gener i denne spesifikke celletypen. Vi brukte deretter genredigeringsteknologien til CRISPR/Cas9 for å kutte ut DNA-sekvensene som normalt binder CTCF, og fant at grensene i disse redigerte cellene ble uskarpe og domenet mistet sin spesifikke form. A-globin forsterkere ikke bare aktiverer a-globin-gener, men krysser domenegrensene og slår på gener i nærliggende domene.
 Vedlikehold av kromosom-antall
Vedlikehold av kromosom-antall
Hvordan garanterer cellene at 23 kromosomer vil ende opp i hver dattercelle? Forskere ved Queen Mary University of London taklet det logistikkspørsmålet -her. De tilbyr et faktum som indikerer nøyaktigheten til kvalitetskontroll-mekanismer: "Celler deles minst en milliard ganger i den gjennomsnittlige personen, vanligvis uten problem." Ikke desto mindre oppstår sjeldne abnormiteter som i tilfelle med Downs syndrom når feil antall kromosomer (aneuploidi) resulterer.
Dr Draviam og hennes kolleger ved University of Cambridge (UK) og European Molecular Biology Laboratory i Heidelberg (Tyskland) oppdaget at to proteiner - Aurora-B kinase og BubR1 tilknyttede PP2A fosfataser - opptrer i motsetning til hverandre, og tilsetter eller fjerner fosfatgrupper henholdsvis, for korrekt å kontrollere vedhenget av mikrotubuler til kromosomene.
Medforfatter Duccio Conti, som er Dr Draviams doktorand, sa: "Vi fant at en balanse mellom Aurora-B kinase og BubR1-bundet fosfatase er viktig for å opprettholde riktig kromosomtall i menneskelige celler."
Bilde 4. Heterozygot genpar
Konklusjoner
På steder i disse artiklene traff forfatterne interessante funn når de gikk på jakt etter funksjon. Det er det design-vitenskap gjør: i stedet for å være en vitenskaps-stopper, som kritikere fremdeles noen ganger sier, motiverer det forskere til å finne årsaken til ting. Systemer som løser store logistikkproblemer, styrer tilgang og vedlikeholder strukturer vitner om intelligente årsaker som har en hensikt (en funksjon) og organiserer deler for å oppnå denne funksjonen. Det er neppe et bedre eksempel i verden på dette, enn det som foregår i kjernen til hver celle.
Oversettelse og bilder ved Asbjørn E. Lund
 Evolution news; 5. september 2017
Evolution news; 5. september 2017 Evolution news; 5. september 2017
Evolution news; 5. september 2017 Ikke-forenkling av kromatin
Ikke-forenkling av kromatin Kontrollerer gentilgang
Kontrollerer gentilgang Vedlikehold av kromosom-antall
Vedlikehold av kromosom-antall